Tabela Periódica - Guia dos Elementos
Variáveis Físicas
A cor de uma amostra de água se deve a absorção de determinados comprimentos de onda da luz visível devido a presença de substâncias dissolvidas.
Não deve ser confundida com a turbidez que é o resultado da absorção e espalhamento da luz devido a partículas em suspensão, como matéria orgânica
ou sedimentos minerais.
Para determinação da “Cor Verdadeira” de uma amostra esta deve ser livre de todos os materiais em suspensão por filtração.
Diversas substâncias orgânicas naturais podem provocar coloração na água como o ácido húmico e ácido fúlvico que deixam a água com cor que
varia do amarelo ao marrom. Na presença de cátions como ferro, a cor pode aumentar devido a formação de complexos solúveis como os humatos férricos.
Outras substâncias solúveis de uso industrial como taninos, ligninas, corantes e muitos metais como ferro, niquel cromo, dicromatos,
cobre também provocam alteração de cor na água e por isso devem ser removidos por tratamento químico.
A medida da “Cor Verdadeira” de uma amostra de água é realizada por comparação com padrões convencionados, como os padrões de coloração
amarelada produzidos pelas soluções de hexacloroplatinato de potássio e cloreto cobaltoso.
De acordo com a American Public Health Association (APHA) uma solução contendo 500 mg/L de Platina proveniente do sal K2PtCl6,
junto com o CoCl2 apresenta cor APHA 500.
A partir desta solução pode-se diluir volumetricamente para padrões de cor menores como 0,1 e 1. A comparação pode ser realizada visualmente em
tubos cilíndricos graduados de grande percurso ótico ou em espectrofotômetros.
A escala de cor APHA foi introduzida em 1892 pelo químico Allen Hazen (1869-1930) para avaliação do nível de poluição em esgotos e por isso é também
chamada de escala Hazen.
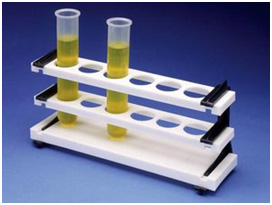
Análise Comparativa de Cor em Tubo
A Turbidez da água é causada pela presença de partículas em suspensão ou materiais coloidais como argilas, terra, areia, plâncton, óxidos, hidróxidos e carbonatos minerais.
A turbidez de uma amostra de água é o grau de atenuação de intensidade que um feixe de luz sofre ao atravessá-la devido principalmente a absorção e espalhamento. As partículas presentes na água são barreiras físicas a passagem da luz.
Partículas maiores bloqueiam mais a luz, enquanto que as menores espalham mais a luz. A determinação do espalhamento da luz acarreta em medições mais precisas da turbidez, por não sofrer interferência da cor da amostra.
Estes turbidímetros são chamados nefelômetros
e apresentam o detector em ângulo de 90º com o feixe incidente.
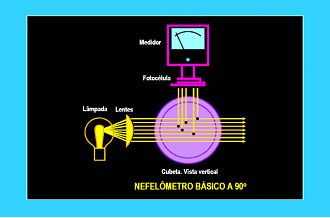
As medidas de turbidez são importantes para se avaliar o grau de potabilidade da água, já que pode
ser provocada por esgotos sanitários, áreas de erosão, extração de minerais, ineficiência no tratamento
de água, presença de óleos e resíduos industriais. Também fornecem medidas para avaliação da
profundidade de penetração da luz na água de um lago ou rio.
Águas muito turvas somente permitem a
vida de organismos vegetais fotossíntetizadores na região onde ocorre a penetração da luz, o que se da
na superfície. Nas regiões do fundo de lagos turvos ocorrem processos anaeróbicos e liberação de gases
tóxicos como o metano e gás sulfídrico, que causam mais estagnação do corpo d’agua e impedem a
proliferação de peixes.
Alta turbidez reduz a fotossíntese de vegetação enraizada submersa e algas. Esse
desenvolvimento reduzido de plantas pode influenciar nas comunidades biológicas aquáticas e afetar
adversamente os usos domésticos, industrial e recreacional da água.
A turbidez é um parâmetro fácil e rápido de ser medido e pode ser monitorado em tempo real. A escala
de turbidez é uma escala operacional convencionada obtida a partir da suspensão do polímero Formazina
produzido pela reação do formaldeído com o sulfato de hidrazina em quantidades padronizadas. A partir
desta suspensão de formazina com valor de 4000 unidades nefelométricas de turbidez (NTU) se obtem
valores menores por diluição, que são comparados com a amostra de água no nefelômetro.

Turbidez de diferentes amostras (NTU)
A condutividade elétrica é uma medida da concentração total de sais dissolvidos presentes na água. Apesar de não fornecer medidas
reais da concentração de um determinado íon presente, ela nos dá uma noção bastante boa da salinidade total, o que indiretamente sugere
a origem e o grau de contaminação da água. Água salobras apresentam elevada condutividade e não são apropriadas para consumo humano.
Água de baixa condutividade, menores que 200 μS/cm indicam que podem ser potáveis por apresentarem concentrações baixas de sais
dissolvidos. A condutividade é um parâmetro importante para diversas atividades industriais como a produção de vapor onde se deseja
água de baixa condutividade para se evitar a formação de incrustações salinas em tubulações e caldeiras e água para uso farmacêutico.
O uso de água destilada ou desmineralizada de baixa condutividade não acarreta prejuízo significativo a alimentação humana, já que a
maior parte dos sais minerais absorvidos pelo organismo vem dos outros tipos de alimentos. Tipicamente a água de um rio que apresenta
condutividade < 200 μS/cm apresenta bom potencial de capitação para abastecimento, pois a concentração de sais dissolvidos é da
ordem de 100 mg/L (ppm).
Os principais sais que contribuem para a condutividade da água natural são os sais de potássio, sódio, cálcio, magnésio na forma de
sulfatos, cloretos, carbonatos e bicarbonatos.
| Amostra | Condutividade típica aproximada a 25°C |
| Água Tipo I (ultrapura) | 0.055 μS/cm |
| Água destilada | 1.0 μS/cm |
| Água Potável | 50 μS/cm |
| Água Mineral | 200 μS/cm |
| Água do Mar | 53000 μS/cm |
A leitura de condutividade é realizada em equipamentos chamados condutivímetros que são medidores da resistência elétrica de um volume
constante de líquido formado entre a área de dois eletrodos de platina.
Sua grande vantagem é que permite leituras rápidas e em tempo real e por isso é largamente utilizada em processos on-line de produção e
tratamento de água.
Para se calibrar estes eletrodos e o equipamento se utilizam soluções de cloreto de potássio (KCl) em concentrações conhecidas, como
aquela com 0,7455 g/L que fornece o valor de 1408 μS/cm a 25ºC.
A condutividade varia com a temperatura e aumenta em aproximadamente 2% por °C para a maioria dos sais como o NaCl e KCl.
Sua unidade no Sistema Internacional (SI) é o siemens (S) e comumente é expressa como microsiemens por centímetro (μS/cm) o que significa a
condutividade medida entre eletrodos de área 1 cm² separados por 1 cm de distância.

Padrões de Condutividade SpecSol®. Confiabilidade para suas análises
Variações de temperatura são parte do regime climático normal e corpos de águas naturais apresentam variações sazonais e diurnas, bem como
estratificação vertical. A temperatura superficial é influenciada por fatores tais como latitude, altitude, estação do ano, período do dia,
taxa de fluxo e profundidade.
A elevação da temperatura em um corpo d'água geralmente é provocada por despejos industriais (indústrias canavieiras, por exemplo) e usinas
termoelétricas.
A temperatura desempenha um papel principal de controle no meio aquático, condicionando as influências de uma série de parâmetros físico-químicos.
Em geral, à medida que a temperatura aumenta, de 0 a 30°C, a viscosidade, tensão superficial, compressibilidade, calor específico, constante
de ionização e calor latente de vaporização diminuem, enquanto a condutividade elétrica e térmica, a pressão de vapor, a solubilidade de sais aumentam
com a elevação da temperatura.
Organismos aquáticos possuem limites de tolerância térmica superior e inferior, temperaturas ótimas para crescimento,
temperatura preferida em gradientes térmicos e limitações de temperatura para migração, desova e incubação do ovo.
Reações redox ocorrem entre muitos constituintes químicos na água potável, industrial e efluentes e também no ambiente aquático. As reatividades e
mobilidades de importantes elementos em sistemas biológicos, como Fe, S, N, C e elementos metálicos, dependem fortemente das condições redox.
Estas reações envolvem transferências de elétrons e prótons e dependem portando do pH e potencial redox do meio (Eh). Juntos estes fatores, além das
atividades de outros íons presentes podem tornar possíveis ou não determinadas reações.
Por exemplo o cátion ferroso não é oxidado com o oxigênio atmosférico ao cátion férrico em pH ácido. A seguinte regra pode ser estabelecida: em meios
com Eh redutor não devem ser encontradas espécies oxidantes e em meios com Eh oxidante não são encontradas espécies redutoras.
As medidas de Eh são fáceis de serem realizadas e permitem leituras em tempo real e por isso são utilizadas em processos de tratamentos químicos de
efluentes, como na redução do cromo hexavalente com dióxido de enxofre ou bissulfito de sódio. Assim garantindo-se um Eh redutor que indica excesso de
bissulfito, não haverá cromo hexavalente no equilíbrio.
A precipitação de metais pesados pela adição de sulfetos somente ocorrem em meio com Eh redutor
e em pH elevado, o que evita a solubilização em pH ácido e oxidação dos sulfetos a sulfatos.
Por outro lado a indicação de um Eh oxidante na água sugere a presença de quantidade suficiente de cloro para esterilizar a água potável. As medidas de Eh
são conduzidas em milivoltímetros, do mesmo tipo usado em medições de pH, empregando um eletrodo indicador inerte como a platina e um eletrodo de
referência tipicamente de cloreto de prata com solução saturada de cloreto de potássio (Ag/AgCl/ KCl sat).
A diferença de potencial entre estes dois eletrodos fornece o potencial redox em relação do eletrodo de hidrogênio (Eh). A utilização do eletrodo padrão de
hidrogênio é impraticável na rotina de laboratório, sendo mais prático a utilização de eletrodos como os de platina, ouro e de carbono.
Conhecendo-se o potencial redox de uma solução padrão de calibração em relação ao eletrodo padrão de hidrogênio em uma determinada temperatura,
pode-se facilmente fazer a extrapolação para o valor de Eh do meio. Assim a solução contendo 0,003M do par redox ferrocianeto/ferricianeto é bastante
estável como padrão de calibração, já que fornece um valor de +229 mV a 25ºC com o eletrodo de platina em relação ao eletrodo de referência
Ag/AgCl/KCl sat. e + 428 mV na mesma temperatura em relação ao eletrodo padrão de hidrogênio e empregando o mesmo eletrodo indicador.
Os raios alfa (α) são núcleos de hélio (4He²+), dotados de carga positiva. Eles se originam da desintegração de isótopos
instáveis de elementos com pesos atômicos superiores a 150. Os raios alfa movem-se lentamente e perdem energia rapidamente por colisões, tendo
assim curto alcance no ar, mas elevada eficiência biológica (1 rem aprox. = 0,05 rad).
Os raios beta (β) são elétrons (ou pósitrons) que têm massa muito pequena, mas podem atingir velocidades quase tão grandes como a velocidade da
luz. Os emissores de radiação beta podem tanto ser núcleos leves como núcleos pesados; o trítio (3H) é um emissor beta. O alcance, no ar, de uma
partícula beta dotada de uma quantidade razoável de energia (1Mev) é de cerca de 3 metros (1 rem aprox. = 1 rad).
Os raios alfa e beta são detidos por folhas delgadas de materiais leves, como alumínio ou "perspex". Substâncias químicas como a cisteamina
(HS – CH2 – CH2 – NH2) impedem com grande eficácia as reações em cadeia e podem assim oferecer uma ampla proteção
contra os danos das radiações, mas somente se forem tomadas antes da exposição à radiação.
Devido ao seu alcance muito limitado, os raios alfa e beta só atuam se estiverem dentro do organismo. Em geral, é o núcleo da célula que é mais
sensível aos danos das radiações.
Portanto, os tecidos sujeitos a maior risco são aqueles em que há uma grande concentração de núcleos com divisão celular freqüente
( por exemplo, a medula óssea).
O DNA do núcleo é danificado muito facilmente por radiações ionizantes. Teoricamente, basta uma alteração química em uma única base purínica
ou pirimidínica de um trecho do DNA para que ocorra uma mutação em um ponto.
É evidente que nunca se pode ter certeza de que uma única alteração química em uma célula não venha a causar uma mutação na célula, fazendo
com que ela se torne mais tarde uma célula cancerosa.
Por isso, é extremamente difícil ter certeza de que existe um limiar, seja para cancerígenos ou para radiações, abaixo do qual o organismo é
imune ao ataque. Por razões de segurança admite-se que, para radiações, não exista um tal limiar.