Tabela Periódica - Guia dos Elementos
Astatínio - At
Apresentação
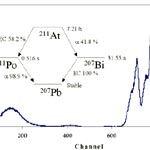
Do Grego Astatos que significa instável. Foi descoberto em 1940 por D.R.Corson, R. Mackenzie e E. Segre nos USA. Obtido sinteticamente pelo bombardeamento do Bismuto com partículas alfa. Seu isótopo mais estável, At-210, tem meia vida de 8.1 horas. Somente pode existir em quantidades ínfimas em equilíbrio nos minerais de urânio. Estima-se que existam menos que 30 g de Astatínio na crosta terrestre. Suas reações são semelhantes aos outros halogênios, mas deve possuir caráter mais metálico que o iodo. Forma ácido astatinídrico (HAt) e compostos inter-halogenados como o AtCl, AtBr e AtI.
Características principais
Este elemento altamente radioativo comporta-se quimicamente como os demais halogênios, especialmente como o iodo. O astato tem caráter mais metálico que o iodo. Pesquisadores do
Laboratório Nacional de Brookhaven identificaram as reações e as medidas elementares que envolvem o astato. A maioria das características do astato são conhecidos através dos seus
isótopos sintéticos.
É o elemento mais pesado entre todos os halogênios, e apresenta cinco estados de oxidação: +7. +5, +3, +1 e -1. Forma compostos com outros halogênios, tais como, AtCl e AtI.
Aplicações
O astato tem maior importância no campo teórico do que no campo prático. Atualmente, não é conhecida nenhuma aplicação prática deste elemento.
Precauções
Por ser altamente radioativo deve ser manuseado, nas investigações científicas, em condições especiais. A quantidade de astato na natureza é tão pequena que não oferece risco a saúde humana. Entretanto, quando injetado em animais, por ser um halogênio instala-se na glândula tiróide do mesmo modo que o iodo. Há indicações que seja altamente cancerígeno.