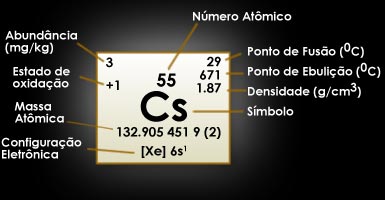
Césio - Cs
Forma química na solução: Cs+ (aq)
Cor da solução aquosa: Incolor
Compatibilidade Química: Estável com todos os cátions metálicos e ânions inorgânicos. Pode ser diluído e adicionado em matrizes ácidas contendo HCl, HNO3, H2SO4 e HF. Evitar uso de HClO4. Em concentrações maiores que 1g/L pode precipitar com complexos halogenados de metais preciosos como o ânion PtCl62- formando Cs2PtCl6 e com o ânion perclorato formando CsClO4.
Estabilidade: A solução é estável por anos em frascos de polietileno (LDPE) em concentrações de 1 – 10.000 mg/L em HNO3 de 1 a 5%. Em concentrações de 0,001 – 1 mg/L é estável por meses em frascos de LDPE em HNO3 1%.
Preparação de Amostras: O metal reage explosivamente com água. Minerais devem ser fundidos com Na2CO3 em cadinho de grafite seguido de solubilização com HCl. Branco deve ser realizado devido a contaminação do Na2CO3 com Rb. Águas salobras, água minerais e soluções somente devem ser diluídas com HNO3 1%. Amostras orgânicas devem ser digeridas com HNO3, H2SO4 e HClO4 ou H2SO4 /peróxido.
Manuseio e armazenagem: Manter o frasco fechado quando não estiver usando. Armazenar a 20oC +/- 5oC. Evitar retorno de solução para o frasco. Não pipetar diretamente do frasco para evitar contaminações.
Informações espectrais:
Cor da solução aquosa: Incolor
Compatibilidade Química: Estável com todos os cátions metálicos e ânions inorgânicos. Pode ser diluído e adicionado em matrizes ácidas contendo HCl, HNO3, H2SO4 e HF. Evitar uso de HClO4. Em concentrações maiores que 1g/L pode precipitar com complexos halogenados de metais preciosos como o ânion PtCl62- formando Cs2PtCl6 e com o ânion perclorato formando CsClO4.
Estabilidade: A solução é estável por anos em frascos de polietileno (LDPE) em concentrações de 1 – 10.000 mg/L em HNO3 de 1 a 5%. Em concentrações de 0,001 – 1 mg/L é estável por meses em frascos de LDPE em HNO3 1%.
Preparação de Amostras: O metal reage explosivamente com água. Minerais devem ser fundidos com Na2CO3 em cadinho de grafite seguido de solubilização com HCl. Branco deve ser realizado devido a contaminação do Na2CO3 com Rb. Águas salobras, água minerais e soluções somente devem ser diluídas com HNO3 1%. Amostras orgânicas devem ser digeridas com HNO3, H2SO4 e HClO4 ou H2SO4 /peróxido.
Manuseio e armazenagem: Manter o frasco fechado quando não estiver usando. Armazenar a 20oC +/- 5oC. Evitar retorno de solução para o frasco. Não pipetar diretamente do frasco para evitar contaminações.
Informações espectrais:
| Técnica | Linhas (nm) | Limite de Detecção LD (mg/L) | Ordem | Tipo | Interferência |
|---|---|---|---|---|---|
| ICP-AES | 455,531 | 3,2 | 1 | átomo | Cr, U, Ce, Ti |
| ICP-MS | 133 uma | 1,7 ppt | --- | M+ | 117Sn16O |
| FAAS | 852,1 | 0,017 (ar-propano) | 1 | átomo | Cs é bastante ionizado mesmo com a chama fria ar-propano e usar 2000 ppm de K ou Na como supressor. |